Propriétés Étonnantes de l'Eau |
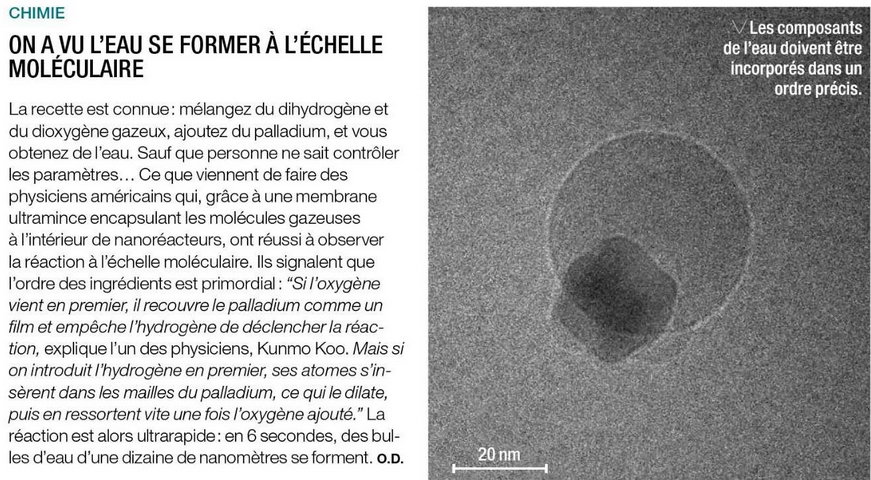
On a Vu l'Eau se Former à l'Échelle Moléculaire |
O.D. - SCIENCE & VIE N°1287 > Décembre > 2024 |
La Goutte d'Eau : Météorite de laboratoire |
PHYSIQUE |

 On peut observer ce phénomène chaque fois qu'il pleut, mais ces clichés à haute vitesse lui donnent une toute autre allure.
On peut observer ce phénomène chaque fois qu'il pleut, mais ces clichés à haute vitesse lui donnent une toute autre allure.
Il s'agit d'une goutte d'eau de 3 millimètres de diamètre rebondissant sur des billes de verre de 90 micromètres.
Des chercheurs de l'université du Minnesota, aux États-Unis, ont analysé précisément son impact.
Leur conclusion est surprenante : le cratère engendré est très similaire à celui que ferait une météorite en s'écrasant sur Terre, quoiqu'à une échelle bien moindre.
Cette analogie leur a permis de faire appel à différents modèles physiques pour comprendre finement le phénomène.
T.P. - LA RECHERCHE N°499 > Mai > 2015 |
En Gelant, la Goutte d'Eau devient Pointue |

 Lorsqu'une goutte d'eau gèle, elle se hérisse !
Lorsqu'une goutte d'eau gèle, elle se hérisse !
C'est ce que vient d'observer Oscar Enriquez, de l'université de Twente aux Pays-Bas, à l'aide d'une caméra rapide couplée à un microscope. "Nous avons exploité les propriétés optiques de l'eau, détaille le chercheur. Nous savions que lorsqu'elle gèle, son indice de réflection, et donc sa couleur, change. Il nous a suffi d'éclairer avec un laser une goutte colorée en rouge, posée sur une surface à -20°C, pour suivre la progression du front de glace". Le physicien s'est alors rendu compte que, sous l'effet de la tension qui règne à la lisière entre les deux milieux, la partie liquide de la goutte prend la forme d'une sphère qui rétrécit au fur et à mesure que la glace progresse, jusqu'à former une pointe une seconde plus tard. "C'est comme s'il se formait une goutte dans la goutte, s'amuse le physicien. Sa taille ne cesse de diminuer, et elle finit par donner naissance à une singularité : une sphère si petite qu'elle peut être assimilée à un point". Un point qui semble avoir la capacité d'attirer la vapeur d'eau : en poursuivant l'observation, les physiciens y ont vu pousser de microscopiques cristaux de glace, tel des arbres au sommet d'une colline.
M.F. - SCIENCE & VIE > Janvier > 2013 |
275 Molécules d'Eau pour Former de la Glace |
275 : C'est le nombre minimum de molécules d'eau nécessaires pour former de la glace.
En étudiant la lumière absorbée par des échantillons contenant de 80 à 500 molécules d'eau, une équipe de l'université allemande de Gottingen a observé qu'en deçà de 275, les molécules sont trop peu pour dessiner les motifs d'un réseau cristallin, même si la température les y oblige.
M.F. - SCIENCE & VIE > Décembre > 2012 |
En Surface, l'Eau n'est qu'à Moitié Liquide |
 L'eau peut être à la fois liquide... et gazeuse. C'est ce que vient d'observer une équipe de l'université du Michigan (États-Unis).
L'eau peut être à la fois liquide... et gazeuse. C'est ce que vient d'observer une équipe de l'université du Michigan (États-Unis).
En utilisant des impulsions lumineuses, les physiciens ont mesuré la vibration de molécules d'eau (H20) et ont découvert que celles situées à l'interface entre l'eau et l'air (en bleu sur le dessin ci-dessous, qui représente un verre d'eau) se distinguaient : "Leurs deux atomes d'hydrogène vibrent à des fréquences différentes, précise Alexander Benderskii, qui a dirigé l'étude.
Celui du dessus bouge très vite, comme s'il était sous forme gazeuse, tandis que celui du dessous vibre lentement, tel un atome de liquide. La molécule est donc mi-liquide, mi-gazeuse !" Les chercheurs s'interrogeaient sur l'épaisseur de la couche de transition entre l'eau et l'air... Ils ont la réponse : tout se joue dans 0,1 nanomètre !
M.F. - SCIENCE & VIE > Septembre > 2011 |
Pourquoi l'Eau ne Brûle-t-elle Pas ? |
Bonne question : l'eau est constituée d'atomes d'oxygène et d'hydrogène (H2O). Or, en présence d'oxygène, l'hydrogène brûle. Pourquoi n'est-ce pas le cas lorsqu'ils sont associés pour former de l'eau ?
La combustion est une réaction chimique au cours de laquelle les molécules qui forment le combustible se fragmentent en entités plus petites et captent des molécules d'oxygène. En termes chimiques, c'est une oxydation. Mais elle est "exothermique" : elle dégage de la chaleur.
UN HYDROGÈNE DÉJÀ LIÉ
Prenons le cas du bois qui brûle. Le dégagement de chaleur fragilise les liaisons qui, au sein des molécules organiques du bois, soudent entre eux les atomes de carbone et d'hydrogène. Au point que ces liaisons cassent pour laisser le carbone se lier à l'oxygène de l'air (le comburant), et l'hydrogène faire de même. Ainsi, les résidus de la combustion sont le dioxyde de carbone (CO2) et l'eau (H2O). À noter que la réaction dégage une chaleur si intense qu'elle excite les gaz impliqués dans la réaction, lesquels donnent alors naissance à la flamme.
Pourquoi l'eau ne fait-elle pas cela ? Parce que l'hydrogène est déjà lié à un atome d'oxygène ! Il ne peut en accueillir plus, sauf à le forcer en lui fournissant de l'énergie pour former une entité instable : de l'eau oxygénée. Mais cette oxydation consomme de l'énergie sans en émettre. Ce n'est pas une combustion. L'eau est même réputée pour lutter contre le feu. D'une part, l'eau vaporisée au contact du feu prend la place de l'air (le volume de l'eau, quand elle passe à l'état de vapeur, augmente 4200 fois) : privé de comburant, le combustible ne brûle plus. D'autre part, l'eau refroidit le combustible et empêche la réaction de se poursuivre. Car la réaction de combustion, si elle émet beaucoup de chaleur, a besoin d'un minimum d'énergie pour débuter.
A.D. - SCIENCE & VIE > Juin > 2011 |