Saturnisme : Le Plomb a livré les Secrets de sa Toxicité |
En mêlant physique quantique et biochimie moléculaire, deux chercheurs montrent qu'une paire d'électrons suffit à bouleverser notre organisme. Vers un espoir de traitement antisaturnisme ?
Le saturnisme est souvent associé à la Rome antique. Si les riches Romains, fréquemment victimes de coliques, maux de tête, stérilité et anémie, ignoraient l'origine de leur mal, on sait depuis bien longtemps qu'ils s'empoisonnaient en fait au plomb, notamment parce qu'ils utilisaient ce métal dans les récipients culinaires. Mais la maladie, ainsi nommée en référence à la planète Saturne, symbole du plomb pour les alchimistes du Moyen Age, frappe toujours. Elle reste un véritable problème de santé publique concernant particulièrement les enfants ("Repères"). Et aucun traitement n'est efficace pour le moment... C'est en associant plusieurs disciplines que les chimistes O. Parisel et C. Gourlaouen ont mis le doigt sur l'origine de la toxicité du plomb.
Repères : Les enfants sont les principales victimes du saturnisme, notamment lorsqu'ils vivent dans des logements anciens et délabrés où les peintures contiennent du sel de plomb. Ils s'intoxiquent en inhalant les poussières ou en ingérant directement les fragments de peinture, au goût sucré. S'ils sont plus sensibles que les adultes, c'est que 40 à 50 % du plomb passent directement dans leur sang, contre 5 à 10 % chez l'adulte. En 1999, l'Inserm estimait qu'en France, 2,1 % des enfants de 1 à 6 ans (84.000) avaient une plombémie sanguine supérieure à 100 ug/l et étaient susceptibles de développer des troubles de la motricité, des retards mentaux et des anémies. Mais le dépistage est encore peu répandu. |
Mais peut-être une voie s'est-elle enfin ouverte : deux chimistes du Laboratoire de chimie théorique de l'université Pierre et Marie-Curie (Paris VI) viennent de découvrir l'origine précise de la toxicité de ce métal ! Et cela, grâce... à la mécanique quantique. Un phénomène rarissime en science : toutes les disciplines se donnent aujourd'hui la main pour livrer une explication complète de la chaîne de phénomènes conduisant au saturnisme. Du diagnostic médical au comportement quantique des électrons de l'atome de plomb, en passant par la biochimie moléculaire des protéines impliquées, c'est l'association de ces différentes sciences qui a permis de répondre à une question restée jusqu'ici ouverte : qu'est-ce qui rend le plomb toxique ? A priori, ce n'est pas sa nature "métallique", puisque certains autres métaux sont tolérés par l'organisme, voire lui sont indispensables. Ainsi du fer, du cuivre ou du zinc, qui constituent 0,01 % de notre masse corporelle.
L'ION PLOMB, PERTURBATEUR
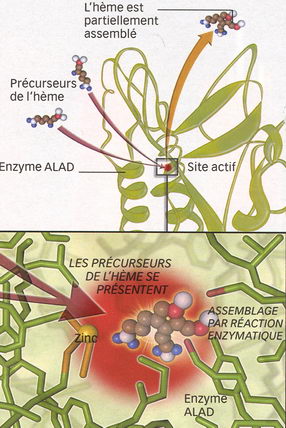
Les trois métaux entrent en effet dans la composition de protéines appelées métalloprotéines, sous leur forme ionique (c'est-à-dire en tant que molécules auxquelles manquent des électrons) Fe2+, Cu2+ et Zn2+. Sous sa forme Pb2+, le plomb est lui aussi un ion. Mais il ne joue aucun rôle physiologique vertueux. Au contraire, c'est un redoutable perturbateur de métalloprotéines ! Et notamment chez l'ALAD, une enzyme essentielle à la fabrication de l'hémoglobine des globules rouges. Au centre de l'ALAD se niche en effet un ion Zn2+. Lors d'une intoxication au plomb, l'ion Pb2+ prend sa place. Conséquence : l'ALAD est inhibée, incapable de jouer son rôle. D'où une sévère anémie.
Même scénario avec la calmoduline, une enzyme régulant le taux de calcium dans l'organisme, dans laquelle le plomb déloge des ions calcium (Ca2+), et l'inactive partiellement. Voilà pour l'explication physiologique. Mais la biochimie ne peut en dire plus sur le rôle du plomb au niveau moléculaire. Notamment sur ce qui le différencie des autres ions métalliques pour perturber à ce point l'activité enzymatique.
LA RÉPONSE EST... QUANTIQUE
C'est ici que la chimie bio-inorganique a pu apporter des compléments de réponse. Cette discipline, apparue il y a seulement une vingtaine d'années, connaît actuellement un vif essor. À l'interface de la chimie et de la biologie, elle s'intéresse à la modélisation, expérimentale ou théorique, des composés métalliques présents dans les organismes vivants. C'est une des spécialités des deux chimistes théoriciens Olivier Parisel et Christophe Gourlaouen de l'université Paris VI. Loin des paillasses et des éprouvettes, ces chercheurs se consacrent à la modélisation.
Dans leurs puissants ordinateurs, ils ont reconstruit l'architecture de la calmoduline et de l'ALAD en prenant en considération le nuage d'électrons qui gravite autour de chaque noyau d'atome et d'ion métallique. Pourquoi ? Parce que ces nuages sont susceptibles d'interagir entre eux et, in fine, d'influencer la configuration géométrique de l'enzyme. Or, c'est la mécanique quantique, science physique de l'infiniment petit, qui règle la disposition électronique de ces nuages. À savoir que les électrons (habituellement représentés, pour simplifier, comme tournant autour du noyau) ne sont pas disposés de manière aléatoire : ils sont répartis par paires sur des "couches" circulaires autour du noyau, un peu comme les planètes sur leurs orbites de gravitation. Ces paires d'électrons forment des liaisons avec les autres atomes : elles se mettent en commun entre deux atomes pour former une liaison moléculaire. Chacune d'entre elles exerce sur les autres des forces électriques répulsives. Afin de minimiser les valeurs de ces forces, les paires se répartissent de manière homogène autour du noyau.
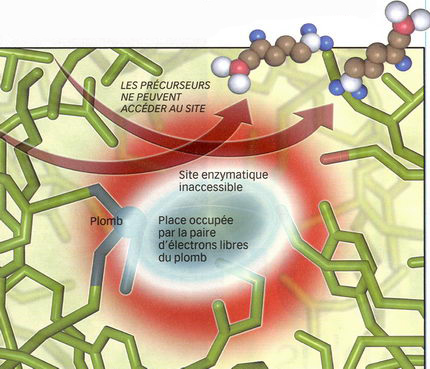
L'ion Pb2+, qui compte 80 électrons, semble parfois oublier cette règle : deux électrons, qui se trouvent sur l'orbite la plus externe, font bande à part en formant une "paire libre", et ne s'engagent pas dans une liaison avec un autre atome. Tout cela dépend de l'environnement de Pb2+. "Quand l'ion du plomb se lie à plus de six autres atomes, la symétrie électronique autour du noyau est respectée, commente Olivier Parisel. Mais lorsqu'il s'engage dans moins de six liaisons, la paire libre a tendance à prendre toute la place qu'il lui est décemment permis d'occuper et à organiser la structure de l'édifice chimique de manière à libérer de la place." Si la chimie l'explique bien en théorie, cela n'a été guère observé expérimentalement. D'où l'intérêt de la modélisation pour voir ce qui se passe réellement à l'intérieur de l'enzyme lorsque le plomb se substitue aux ions naturels. Dans le cas de la calmoduline, Pb2+ se fixe aux sept atomes tapissant le cour de l'enzyme. Pour permettre à la paire libre de se faire une place, l'enzyme doit s'ajuster et se déforme anormalement. "L'enzyme est perturbée par ce changement de conformation, précise Olivier Parisel. Sans doute est-ce pour cela qu'elle perd de son efficacité. "Mais le phénomène est encore plus flagrant dans le cas de l'ALAD, où le plomb se lie à seulement trois atomes. La paire libre profite alors de la moitié de l'espace qui lui est offert pour s'étaler. "Il se forme un véritable bouclier électronique qui repousse le substrat naturel de la protéine et l'empêche de se fixer dans son site enzymatique, poursuit le chimiste. L'enzyme est alors totalement inapte à remplir sa fonction biologique." La toxicité du plomb semble donc résider dans cette seule paire d'électrons et dans sa capacité à se déformer et à repousser les atomes qu'elle côtoie. Pour preuve : ce bouclier électronique est propre au plomb. Il n'existe ni dans le calcium ni dans le zinc.
Quand 2 électrons du plomb empêchent l'enzyme de jouer son rôle L'enzyme ALAD est dotée d'un site actif qui intervient dans la synthèse de l'hème, le centre transporteur d'oxygène de l'hémoglobine. Quand, au cour de ce site actif, l'un des constituants, le zinc, est remplacé par un atome de plomb, l'enzyme ALAD ne fonctionne plus. |
|
 |
 |
| 1/ Le site est accessible Le site actif est un espace au sein de la structure de l'enzyme (en vert). C'est ici qu'en présence de l'atome de zinc, l'hème va commencer à être assemblé. |
2/ L'atome de plomb bloque la fabrication de l'hème Dans le site actif, quand le zinc est remplacé par un atome de plomb, les électrons libres de ce dernier occupent tout l'espace disponible, rendant l'accès impossible aux précurseurs de l'hème. |
EXTRAIRE LE PLOMB DU CORPS ?
Cette découverte ouvrira-t-elle enfin la voie à un traitement du saturnisme ? Les deux chimistes l'envisagent via la mise au point d'un agent chimique capable d'arracher le plomb de l'organisme. Ce qu'ils appellent un "chélatant". De tels agents, la médecine en utilise déjà, mais ils ont souvent l'inconvénient de n'être pas assez sélectifs : ils extraient le plomb, mais malheureusement aussi les cations métalliques essentiels à l'organisme. Ce qui oblige à suivre, en cas de traitement par chélation, une cure supplémentaire d'oligo-éléments. Qui plus est, d'autres chélatants arrachent bien le plomb spécifiquement, mais le redéposent dans un autre organe avant qu'il ait pu être naturellement éliminé. L'enjeu pour les deux chimistes est donc double : accroître la sélectivité d'un chélatant vis-à-vis du plomb, mais sans exacerber l'activité dévastatrice du bouclier électronique. Pour y parvenir, il faudra sans doute laisser de côté la chimie quantique et revenir à l'expérimentation de paillasse. Là où se rejoignent finalement la chimie et la biologie...
Olivier Donnars - SCIENCE & VIE > Juillet > 2007 |