Épigénétique : Modifications de notre ADN et Environnement |
Sérotonine et Épigénétique |
A.G. - POUR LA SCIENCE N°499 > Mai > 2019 |
Grandir dans un Milieu Défavorisé et Instable Altère le Génome |
On savait que le stress contribuait à accélérer chez les adultes un processus naturel : le raccourcissement des télomères (les extrémités protectrices des chromosomes) avec l'âge. Mais c'est la première fois qu'une étude est menée chez des enfants (40 garçons âgés de 9 ans).
Des chercheurs de l'université du Michigan ont constaté que les télomères de ceux vivant dans des conditions difficiles étaient plus courts de 19 % par rapport à ceux des enfants issus de milieux favorisés. À l'inverse, les enfants dont la mère a fait des études supérieures ont des télomères 32 % plus longs, et ceux qui grandissent dans une famille stable ont des télomères 40 % plus longs que les enfants vivant dans une cellule famillale déstructurée. Or, des télomères courts, au fil du temps, altèrent les chromosomes et augmentent le risque de contracter des maladies liées à l'âge.
B.Ro. - SCIENCE & VIE N°1161 > Juin > 2014 |
L'ADN peut Varier en Fonction des Saisons |
Reproduction au printemps, hibernation en hiver... si de nombreux animaux ont un comportement variable selon les saisons, c'est parce que leur ADN se transforme !
Des chercheurs de l'université de Chicago ont montré que, dans le cerveau de hamsters se reproduisant au printemps et en été, un gène inhibiteur de la reproduction est compacte, et donc inactivé, à mesure que les jours se rallongent. Ce qui permet la production d'hormones sexuelles. À l'automne, le gène se décompacte peu à peu.
E.A. - SCIENCE & VIE N°1155 > Décembre > 2013 |
Le Stress affecte-t-il notre patrimoine Génétique ? |
 C'est désormais un fait établi : un stress répété, comme une tristesse durable, modifie notre corps... jusqu'à son patrimoine génétique ! Non seulement le stress entraîne le vieillissement prématuré des "capuchons" des chromosomes, mais il s'inscrit dans nos gènes, modifiant nos comportements. Des anomalies qu'une mère peut transmettre à son enfant (->).
C'est désormais un fait établi : un stress répété, comme une tristesse durable, modifie notre corps... jusqu'à son patrimoine génétique ! Non seulement le stress entraîne le vieillissement prématuré des "capuchons" des chromosomes, mais il s'inscrit dans nos gènes, modifiant nos comportements. Des anomalies qu'une mère peut transmettre à son enfant (->).
La preuve formelle a été apportée en 2004 par la biologiste australo-américaine Elizabeth Blackburn, prix Nobel de médecine 2009, et Elissa Epel, psychiatre à l'université de Californie. En comparant l'ADN de mères d'enfants en bonne santé à celui de mères d'enfants atteints d'une maladie grave et chronique, comme l'autisme, ou souffrant d'un handicap moteur ou cérébral, elles ont découvert que les secondes, soumises à um stress psychologique chronique, présentaient des signes de vieillissement précoce dans leur ADN. Comme s'il était "rongé" par l'angoisse.
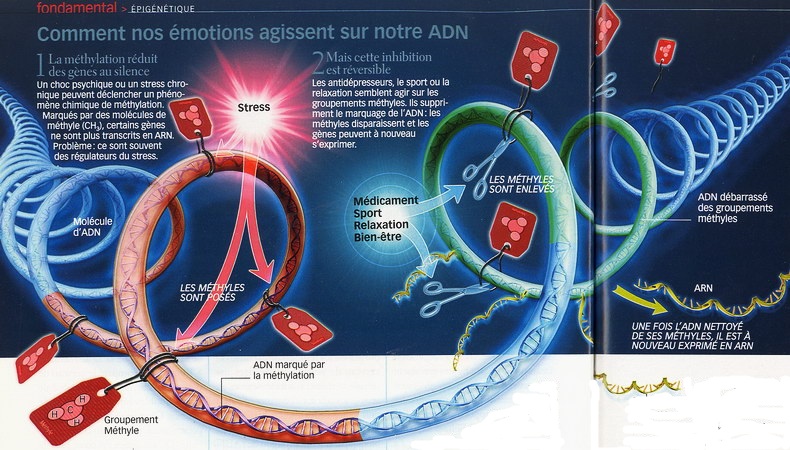
INSCRIT DANS NOS GÈNES : L'image est d'autant plus juste quand on regarde ce qui se passe au cour de nos cellules, là où l'ADN est condensé sous forme de chromosomes. À l'extrémité de ceux-ci se trouvent les télomères, sortes de "capuchons" qui les protègent de l'érosion au fil des divisions cellulaires. Ceux-ci raccourcissent progressivement au fur et à mesure que la cellule vieillit. Or, chez les mères angoissées, les télomères sont apparus anormalement courts, reflétant un vieillissement accéléré. Ils semblaient appartenir à des personnes plus âgées de 9 à 17 ans ! Comment expliquer le lien entre les émotions et l'ADN ? Pour l'heure, le mécanisme biologique précis est encore inconnu. Le cortisol, l'hormone du stress libérée par des petites glandes situées au-dessus des reins (les surrénales), pourrait être impliqué. Peut-être en interagissant avec l'activité de la molécule chargée de l'entretien des télomères, la télomérase. Quoi qu'il en soit, le stress ne s'attaque pas seulement aux télomères : il inscrit aussi sa marque sur nos gènes eux-mêmes, modifiant ainsi de façon ciblée et durable certains de nos comportements. Cette action relève d'un phénomène biologique baptisé l'épigénétique, par lequel l'ADN est modifié chimiquement par des petites "étiquettes" - des groupements méthyles, dans le jargon des biochimistes - qui empêchent physiquement l'expression de certains gènes. Or, les scientifiques ont constaté que le stress et les traumatismes psychiques entraînent des erreurs d'étiquetage épigénétiques dans la zone cérébrale qui gère les émotions, l'hippocampe. À preuve cette expérience réalisée sur des bébés rats : délaissés par leur mère, ils présentent des modifications génétiques qui bloquent le récepteur aux corticoïdes dans l'hippocampe. Or, ce récepteur contrôle la réponse au stress en réduisant le taux sanguin de cortisol. Du coup, les ratons délaissés deviennent moins bien armés pour faire face au stress. Perpétuellement angoissés, ils souffrent de troubles de la mémoire et d'un comportement dépressif. Une observation confirmée chez l'homme : des personnes décédées par suicide et qui avaient subi des sévices sexuels dans l'enfance présentent aussi le gène du récepteur aux corticoïdes bloqué par une méthylation de l'ADN des neurones de l'hippocampe. Et ces anomalies peuvent même se transmettre : lorsqu'une femme est dépressive ou anxieuse pendant la grossesse, le bébé a tendance à présenter un marquage épigénétique anormal sur le gène du récepteur aux corticoïdes. Avec pour conséquence un nourrisson au taux de cortisol élevé, donc très sensible au stress.
Toutes ces observations ne sont pas forcément des mauvaises nouvelles : si notre corps réagit à la pression extérieure, cela signifie aussi que l'on peut se servir de cette pression dans un but bénéfique. Ainsi, les effets épigénétiques causés par le stress peuvent-ils être annulés grâce à une prise en charge. Cela a déjà été fait chez la souris avec des antidépresseurs ou des medicaments destinés à la regulation des troubles de l'humeur. Plus simplement, les effets du stress pourraient être inversés avec de l'activité physique et... de la relaxation !
M.Co. - SCIENCE & VIE QUESTIONS RÉPONSES N°6 > Janvier > 2011 |
Épigénétique : Nos États d'âme modifient notre ADN |
 À contre-pied du déterminisme implacable du "tout-génétique", de nombreux chercheurs constatent aujourd'hui que nos expériences, nos émotions, nos actions façonnent l'expression de nos gènes en permanence. Si l'on sait depuis longtemps que le stress et les traumatismes psychiques influent à la fois sur les comportements et sur la santé, les récents travaux montrent qu'ils attaquent directement l'ADN.
À contre-pied du déterminisme implacable du "tout-génétique", de nombreux chercheurs constatent aujourd'hui que nos expériences, nos émotions, nos actions façonnent l'expression de nos gènes en permanence. Si l'on sait depuis longtemps que le stress et les traumatismes psychiques influent à la fois sur les comportements et sur la santé, les récents travaux montrent qu'ils attaquent directement l'ADN.
Violences, mauvais traitements, abus sexuels, abandon et autres traumatismes psychologiques laissent une trace indélébile à l'âge adulte, comme l'avait déjà observé Sigmund Freud il y a plus d'un siècle. Depuis, une multitude d'études cliniques l'ont confirmé : ceux qui ont subi de grands traumatismes dans l'enfance sont globalement plus sujets à la dépression, à la toxicomanie, aux comportements asociaux, mais aussi à l'obésité, au diabète et aux maladies cardiovasculaires. Pis, ce mal-être s'ancre parfois en nous... avant la naissance ! Car d'autres études montrent que les enfants dont la mère a subi un stress psychologique prolongé ou un traumatisme psychique intense pendant la grossesse ont plus de risques que les autres d'être anxieux, dépressifs, voire schizophrènes. C'est un fait que la psychologie a établi et qui fait consensus : il existe un lien entre traumatismes psychiques et comportements. Quel lien ? Comment des expériences négatives peuvent-elles s'inscrire dans l'organisme, au point d'affecter durablement le comportement ou la santé ?
L'EFFET DE L'ESPRIT SUR LE CORPS
Le secret de cette empreinte biologique serait niché au cour de nos cellules, là où les effets du stress perturbent l'organisme en s'attaquant à l'ADN. Ce pouvoir étrange de l'esprit sur le corps, la biologiste australo-américaine Elizabeth Blackburn, prix Nobel de médecine 2009, et Elissa Epel, psychiatre à l'université de Californie, l'ont montré en 2004 en comparant l'ADN de mères d'enfants en bonne santé à celui de mères d'enfants atteints d'une maladie grave et chronique, comme l'autisme ou un handicap moteur et cérébral. Eh  bien, chez ces dernières, soumises au stress psychologique chronique, l'ADN présente des signes de vieillissement précoce... Comme s'il était "rongé" par l'angoisse. Plus précisément, c'est l'extrémitédes chromosomes qui est atteinte. En effet, au cour des cellules, l'ADN est condensé sous forme de chromosomes, à l'extrémité desquels se trouvent des "capuchons" appelés télomères qui les protègent de l'érosion au fil des divisions cellulaires. Cependant, ils raccourcissent progressivement au fur et à mesure que la cellule vieillit. Or, chez ces mères angoissées, les télomères sont anormalement courts, reflétant un vieillissement accéléré de 9 à 17 ans ! "Nous observons ainsi un lien direct entre les émotions et ce qui se passe dans la cellule, précise Elissa Epel. Et nous avons aussi constaté que lorsque le niveau de stress diminue la longueur des télomères augmente !" Comment le stress pourrait-il raccourcir les télomères ? "On ne comprend pas encore le mécanisme, reconnaît Elizabeth Blackburn. Nous cherchons du côté des interactions entre le cortisol, l'hormone du stress, dont le taux élevé est associé à une réduction de l'activité de la télomérase, la molécule chargée de l'entretien des télomères."
bien, chez ces dernières, soumises au stress psychologique chronique, l'ADN présente des signes de vieillissement précoce... Comme s'il était "rongé" par l'angoisse. Plus précisément, c'est l'extrémitédes chromosomes qui est atteinte. En effet, au cour des cellules, l'ADN est condensé sous forme de chromosomes, à l'extrémité desquels se trouvent des "capuchons" appelés télomères qui les protègent de l'érosion au fil des divisions cellulaires. Cependant, ils raccourcissent progressivement au fur et à mesure que la cellule vieillit. Or, chez ces mères angoissées, les télomères sont anormalement courts, reflétant un vieillissement accéléré de 9 à 17 ans ! "Nous observons ainsi un lien direct entre les émotions et ce qui se passe dans la cellule, précise Elissa Epel. Et nous avons aussi constaté que lorsque le niveau de stress diminue la longueur des télomères augmente !" Comment le stress pourrait-il raccourcir les télomères ? "On ne comprend pas encore le mécanisme, reconnaît Elizabeth Blackburn. Nous cherchons du côté des interactions entre le cortisol, l'hormone du stress, dont le taux élevé est associé à une réduction de l'activité de la télomérase, la molécule chargée de l'entretien des télomères."
Fixés aux extrémités de chaque chromosome, les télomères raccourcissent progressivement au fil de l'âge. Mais un stress chronique peut les réduire de manière anormale, jusqu'à accélérer le vieillissement cellulaire de plusieurs années (->).
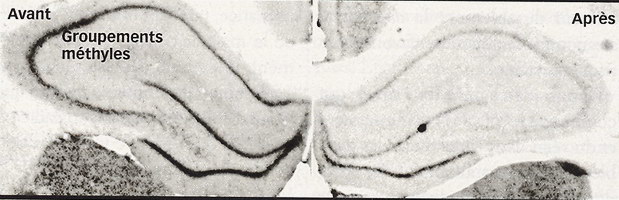
Les changements de méthylation temporaires sont visibles sur l'hippocampe d'un rat soumis à un stress important. À dr., les groupements méthyles, en noir, sur les gènes des neurones, ont disparu.
Mais ce n'est pas tout. Car non content de s'attaquer aux télomères, l'état de stress inscrit sa marque directement sur nos gènes, modifiant de façon ciblée et durable certains de nos comportements. Cette action relève d'un phénomène biologique dont l'importance se dévoile de plus en plus aujourd'hui : l'épigénétique, terme désignant les modifications chimiques qui affectent l'ADN, autres que les mutations qui touchent la structure même de la molécule. Ces modifications épigénétiques sont comme de petites "étiquettes" - des groupements méthyles - qui indiquent à la machinerie cellulaire quels gènes elle doit utiliser ou, au contraire, ignorer. À la clé ? La méthylation empêche physiquement l'expression des gènes en se plaçant sur l'ADN (voir infographie).
Or, les biologistes constatent que stress et traumatismes psychiques entraînent des erreurs d'étiquetage épigénétique dans la zone cérébrale qui gère les émotions, l'hippocampe... Une équipe menée par Michael Meaney, à l'université McGill (Canada), l'a montré en 2004 en comparant le cerveau de bébés rats cajolés par leur mère à ceux de ratons délaissés.  Le délaissement induit des modifications épigénétiques qui bloquent le gène utilisé pour produire le récepteur aux corticoïdes dans l'hippocampe. Or, ce récepteur contrôle la réponse au stress en réduisant le taux sanguin de cortisol, l'hormone libérée en cas de stress. En clair, les rats délaissés possèdent moins de récepteurs au cortisol, et sont alors moins armés pour faire face au stress. Perpétuellement angoissés, ils souffrent de troubles de la mémoire et d'un comportement dépressif. Même à l'âge adulte, le moindre dérangement prend chez eux des proportions alarmantes...
Le délaissement induit des modifications épigénétiques qui bloquent le gène utilisé pour produire le récepteur aux corticoïdes dans l'hippocampe. Or, ce récepteur contrôle la réponse au stress en réduisant le taux sanguin de cortisol, l'hormone libérée en cas de stress. En clair, les rats délaissés possèdent moins de récepteurs au cortisol, et sont alors moins armés pour faire face au stress. Perpétuellement angoissés, ils souffrent de troubles de la mémoire et d'un comportement dépressif. Même à l'âge adulte, le moindre dérangement prend chez eux des proportions alarmantes...
Ces deux souris Agouti sont dotées d'un gène de la couleur du pelage identique. Selon le degré de méthylation de ce gène, lié au stress, l'une est jaune, avec même une susceptibilité à l'obésité, et l'autre brune et sans problème de santé (->).
Ce fascinant résultat peut-il être extrapolé à l'homme ? Oui, répondent les mêmes chercheurs qui, en mars 2009, ont publié les résultats de l'analyse du cerveau de personnes décédées par suicide, certaines ayant été victimes de sévices sexuels dans l'enfance, d'autres non. Chez celles ayant subi des abus, le gène du récepteur aux corticoïdes est bloqué par une méthylation de l'ADN des neurones... de l'hippocampe, tout comme chez les rats abandonnés. "Ces personnes ont donc naturellement un taux de cortisol élevé, ce qui est souvent associé à un état dépressif majeur", explique Moshe Szyf, l'un des auteurs de l'étude. Ainsi, en affectant les gènes qui permettent de lutter contre les tensions, les traumatismes précoces altèrent durablement la capacité à surmonter les difficultés, favorisant le risque suicidaire.
Depuis deux ans, les études qui confirment le rôle de l'environnement et du vécu dans l'apparition des troubles mentaux se multiplient. En 2008, des chercheurs canadiens du Centre de l'addiction et de la santé mentale, à Toronto, ont comparé le cerveau de personnes atteintes de schizophrénie ou de troubles bipolaires à celui de témoins. Chez les premières, 40 gènes présentaient une méthylation anormale. Or, ces gènes s'avèrent pour la plupart impliqués dans le développement cérébral ou la transmission des messages entre les neurones.
Certes, les scientifiques sont encore loin de pouvoir faire la part du biologique dans les maladies psychiatriques. Mais certaines données sont troublantes : c'est parfois en remontant très loin dans l'histoire d'un individu, avant sa naissance, que l'on trouve la "source" de la maladie. Ainsi, en 2008 également, une étude danoise menée sur 1,38 million de femmes a montré que le fait d'être confronté à la maladie ou au décès d'un proche juste avant ou pendant la grossesse augmente de 67 % le risque de schizophrénie chez l'enfant à naître. En outre, lorsqu'une femme est dépressive ou anxieuse pendant sa grossesse, le bébé a tendance à présenter un marquage épigénétique anormal sur le gène du récepteur aux corticoïdes. Avec pour conséquence un nourrisson au taux de cortisol élevé, très sensible au stress. La preuve que nos gènes gardent la cicatrice des événements vécus avant même la naissance ! "Je pense que la plupart des maladies chroniques comme l'asthme, le cancer, le diabète, l'obésité et des maladies neurologiques (autisme, troubles bipolaires, schizophrénie) résultent en partie d'une mauvaise régulation épigénétique lors des premiers stades de développement", estime Randy Jirtle, directeur du laboratoire d'épigénétique à la Duke University, aux États-Unis. Alors que le génome d'un individu reste très stable au cours de sa vie, l'ensemble des marques épigénétique qui régulent l'expression des gènes - son "épigénome" - varie constamment, en réaction aux variations extérieures... Et c'est justement son rôle : "L'épigénome est une interface entre nos gènes, qui sont statiques, et notre environnement, variable", explique Randy Jirtle. Ainsi, la "partition"génétique reste la même, mais son interprétation peut varier au cours de la vie, en fonction de son marquage épigénétique.
DES EMPREINTES POSITIVES
Mais alors, si le marquage épigénétique est dynamique, serait-il réversible ? L'expérience de chercheurs de l'université Rockefeller, à New York, le laisse penser. Ils ont réussi en novembre 2009 à "annuler" les effets épigénétiques causés par le stress dans le cerveau de souriceaux, en leur donnant... du Prozac, un anti-dépresseur. Mieux, la trichostatine A, un médicament proche du valproate, utilisé pour réguler les troubles de  l'humeur dans certaines psychoses, a permis de supprimer le marquage épigénétique anormal et de corriger le comportement de rats adultes ayant été négligés par leur mère à la naissance.
l'humeur dans certaines psychoses, a permis de supprimer le marquage épigénétique anormal et de corriger le comportement de rats adultes ayant été négligés par leur mère à la naissance.
En outre, les émotions positives peuvent heureusement, elles aussi, laisser leur empreinte. En 2008, des travaux menés au Massachusetts General Hospital ont montré que huit semaines de relaxation suffisaient à modifier l'expression de plusieurs centaines de gènes, selon un profil totalement opposé à celui induit par le stress. Par ailleurs, une nouvelle étude menée à l'université de Saarland, à Hambourg, vient de montrer que l'activité physique ralentit le raccourcissement des télomères dans les globules blancs. De son côté, Elissa Epel lance une étude pour étudier les effets de la méditation sur la longueur des télomères.
"En fait, le message de l'épigénétique est optimiste. Ses empreintes peuvent être inversées, et nous cherchons maintenant à utiliser des médicaments agissant sur ce marquage pour soigner les maladies mentales, explique Moshe Szyf. Il y a aussi des chances pour que le soutien social et psychologique suffise à corriger le marquage épigénétique chez les personnes à risque". Ainsi, contrairement à ce qu'affirmaient les scientifiques dans les années 1990, nous ne sommes pas uniquement le produit de nos gènes. Nos expériences, nos émotions, nos actions façonnent l'expression de ces gènes en permanence. Avec la certitude que rien n'est irrémédiable.
TRANSMIS SUR AU MOINS DEUX GÉNÉRATIONS Empreinte de nos expériences au cour de nos cellules, le marquage épigénétique de nos gènes peut se transmettre à la descendance. Et lui faire ainsi subir le poids de notre passé. C'est ce que révèle une étude célèbre, menée en 1992 sur la famine ayant frappé les Pays-Bas en 1945. En réaction au manque de nourriture, les bébés conçus à cette période étaient plus petits que la moyenne, et avaient plus de risque, à l'âge adulte, d'être atteints de diabète ou de maladie cardiovasculaire. Jusque-là, rien que d'attendu. Mais ce qui étonne, c'est que leurs propres enfants souffrent eux aussi d'un faible poids de naissance et d'une mauvaise santé. La cause ? L'empreinte épigénétique laissée par la famine a été transmise sur deux générations. Certes, les marques épigénétiques sont réversibles et malléables, mais elles peuvent donc aussi être transmises presque à l'identique à la descendance. À une condition : qu'elles soient "imprimées" dans les spermatozoïdes ou les ovules. Or, le stress psychologique, lui, ne semble laisser ses marques que dans le cerveau. "Il est possible que les abus subis dans l'enfance entrainent des changements épigénétiques dans les cellules reproductrices, mais nous n'en savons rien", conclut Moshe Szyf. La question reste donc ouverte. |
M.C. - SCIENCE & VIE > Mars > 2010 |