Épigénétique : la Nouvelle Science détrône le Gène |
Au États-Unis, 190 millions de dollars débloqués pour le projet "épigénome"... Non, le génome n'est pas le seul support de l'hérédité. Grâce à l'épigénétique, on peut modifier l'expression des gènes sans "toucher" à l'ADN. De nouveaux traitements en perspective ?
Overkalix, un petit village isolé du nord de la Suède, à la fin du XXè siècle. Les années de bonnes récoltes succèdent aux années de famine. En compilant les archives du village de 1890 à 1995, le généticien anglais Marcus Pembrey fait une découverte étonnante : les enfants de la troisième génération, aujourd'hui âgés, souffrent quatre fois plus souvent de diabète de type 2 si leur grand-père a connu une période de bonnes récoltes pendant sa préadolescence. Comment un événement survenu dans la vie des grands-parents peut-il avoir des répercussions deux générations plus tard ? Simplement parce que, contrairement à ce qu'en dit la génétique classique, nous transmettons à nos enfants bien plus que des gènes. Comme des interrupteurs, les événements qui surviennent dans nos vies ont le pouvoir de mettre nos gènes en mode on ou off, c'est-à-dire de leur permettre de s'exprimer ou de les en empêcher. Si l'événement survient au moment où spermatozoïdes et ovules sont formés, l'état de ces interrupteurs est transmis à la descendance en même temps que les gènes. À en croire les chercheurs de l'université de Columbia (États-Unis), qui ont publié en 2008 une étude sur les effets de la famine pendant la guerre de 1945 aux Pays-Bas, ces interrupteurs auraient la forme d'une molécule de méthyle déposée sur l'ADN. Il ne s'agit que d'une étude préliminaire, mais c'est, chez l'homme, la première description à l'échelle moléculaire d'un phénomène largement décrit chez la plante et l'animal : notre mode de vie laisse sur nos cellules une trace transmissible d'une génération à l'autre.
La génétique traditionnelle selon laquelle les gènes sont les seuls porteurs de l'hérédité en prend un coup. "Il y a quelques années, affirmer que certains caractères acquis pouvaient être transmis passait pour de l'hérésie", explique Andras Paldi, généticien au Généthon d'Evry. "Depuis, l'idée a fait son chemin, et on la retrouve dans les plus grandes revues scientifiques sous le nom d'épigénétique." Comprenez "au-delà des gènes". Selon le biologiste Richard Strohman, l'épigénétique, qui fait aujourd'hui fureur dans les laboratoires du monde entier, apportera à la génétique la révolution que la théorie relativiste d'Einstein apporta à la physique. Et cette révolution trouve déjà des applications dans le domaine médical.
Petit retour en arrière... Depuis des décennies, les généticiens s'échinent à nous expliquer que le génome est le grand livre du vivant : tout est inscrit une bonne fois pour toutes dans l'ADN que nous transmettent nos parents, du "plan" de notre organisme aux prédispositions aux maladies. Aussi séduisante soit-elle, cette théorie de "l'ADN tout-puissant" a bu la tasse. Les questions qu'elle avait soigneusement éludées sont remontées à la surface : si tout est dans l'ADN, comment expliquer que de vrais jumeaux vivant dans le même environnement et qui ont hérité des mêmes gènes, n'aient pas les mêmes empreintes digitales et développent parfois des maladies différentes ? Comment les cellules de notre corps qui portent toutes une copie identique de notre génome peuvent-elles devenir cellules de la peau, du cour, du foie ? Comment un organisme aussi complexe que l'être humain peut-il être le produit de seulement 25.000 gènes, soit 10.000 de plus qu'un simple grain de riz. Avec le séquençage du génome humain en 2001, les scientifiques prennent conscience qu'un ensemble de gènes n'explique pas à lui seul la complexité d'un être vivant. "Espérer comprendre le fonctionnement d'un organisme humain en faisant la liste de ses gènes revenait à essayer de comprendre comment vole un avion à partir du catalogue de ses pièces détachées", estime Andras Paldi. En revanche, l'idée que les gènes peuvent être tantôt en mode on, tantôt en mode off apporte à notre génome une infinité de combinaisons. "En faisant la une du magazine Science en 2001, l'épigénétique arrive à point nommé pour prendre le relais du tout-ADN qui s'essoufflait sérieusement, ajoute Andras Paldi. Depuis, on y fourre tout ce que l'étude des gènes ne peut expliquer."
Après la période du tout-ADN, la génétique entre donc dans l'ère de l'épigénétique. Pour bien comprendre la différence, Thomas Jenuwein, directeur du réseau Épigénome et de l'Institut d'immunologie Max-Planck (Allemagne) compare la génétique et l'épigénétique à l'écriture d'un livre et à sa lecture. Une fois le livre écrit, le texte est le même dans tous les exemplaires. Cependant, chaque lecteur en aura une interprétation légèrement différente. Il lira certains paragraphes, et en sautera d'autres. Au final, chacun en tirera quelque chose de différent. Retour à l'échelle d'une cellule. Bien que chaque cellule du corps (chaque lecteur) reçoive le même génome (le livre), chacune en tire quelque chose de différent selon le contexte dans lequel elle évolue : "Contrairement à ce que l'on croyait, même dans une culture de cellules in vitro, deux cellules filles ne sont pas parfaitement identiques à la cellule mère, remarque Andras Paldi. Même si elles ont hérité du même génome, les cellules n'expriment pas les mêmes gènes selon leur position dans le milieu de culture, c'est-à-dire selon qu'elles se trouvent au bord ou au centre de la boîte." À l'échelle d'un organisme entier, c'est notre environnement qui allumerait ou éteindrait tel ou tel gène. Exemple, chez l'homme : l'exposition aux hydrocarbures aromatiques polycycliques des pots d'échappement. On la savait liée à l'asthme chez l'enfant, mais en mai 2009, les chercheurs de l'université de Cincinnati (États-Unis) ont apporté un éclairage nouveau : la pollution affecterait le gène ACSL3, connu pour jouer un rôle dans le maintien des membranes des cellules pulmonaires. Il est inhibé chez 81 % des enfants dont la mère a été exposée à cette pollution pendant la grossesse. En amont de ce gène, les chercheurs détectent une molécule de méthyle accrochée à l'ADN. Déposée là par une enzyme, l'ADMT (ADN méthyltransférase), cette molécule naturellement présente dans les cellules agit comme unpanneau "stop". La machinerie cellulaire censée lire et traduire les instructions du gène s'arrête. Aucune protéine ne sera fabriquée à partird'ACSL3. Ce mécanisme, appelé "méthylation de l'ADN",est l'un des trois mécanismes épigénétiques de contrôle des gènes connu à ce jour. Le deuxième mécanisme consiste àrendre le gène inaccessible en l'enfermant dans une boîte fermée à clé. Dans le rôle de la serrure, les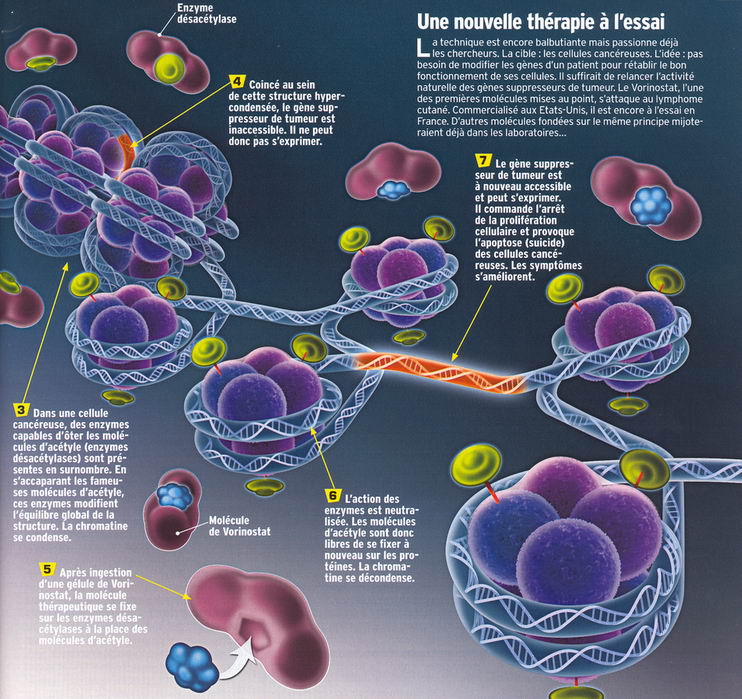
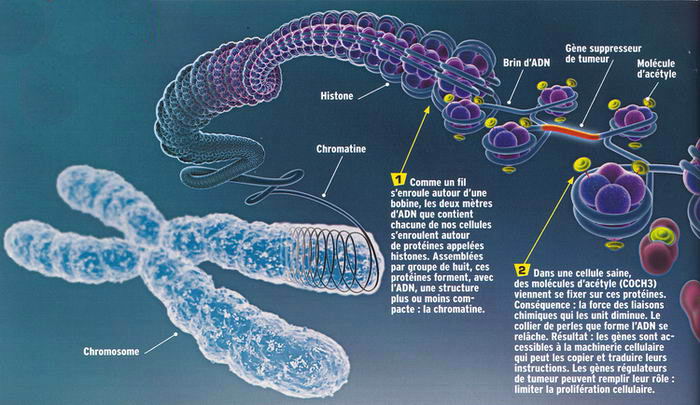 protéines autour desquelles s'enroule le brin d'ADN (les histones). Lorsque l'enzyme HDAC (histone désacétylase) leur retire leur clé (des molécules d'acétyle, de méthyle ou de phosphore), ces protéines se resserrent entre elles, à tel point que l'ADN devient inaccessible à la machinerie de traduction. Le gène est inhibé (infographie ->). Le troisième mécanisme laisse en revanche l'ADN s'exprimer. La censure se fait au niveau de son messager, l'ARNm, censé transférer les instructions du gène vers les usines à fabriquer les protéines. En se fixant dessus, un microARN provoque sa destruction. L'information ne sera jamais traduite. Le gène est réduit au silence.
protéines autour desquelles s'enroule le brin d'ADN (les histones). Lorsque l'enzyme HDAC (histone désacétylase) leur retire leur clé (des molécules d'acétyle, de méthyle ou de phosphore), ces protéines se resserrent entre elles, à tel point que l'ADN devient inaccessible à la machinerie de traduction. Le gène est inhibé (infographie ->). Le troisième mécanisme laisse en revanche l'ADN s'exprimer. La censure se fait au niveau de son messager, l'ARNm, censé transférer les instructions du gène vers les usines à fabriquer les protéines. En se fixant dessus, un microARN provoque sa destruction. L'information ne sera jamais traduite. Le gène est réduit au silence.
En éteignant certains gènes ou en en allumant d'autres au mauvais moment, ces mécanismes épigénétiques sont à l'origine de dérèglements, et donc de maladies. Le National Institute of Health (NIH), ministère de la Santé américain, vient d'accorder 62 millions de dollars à 22 laboratoires de recherche pour enquêter sur le sujet. En Europe, les scientifiques se sont fédérés autour du réseau Epigénome constitué d'une soixantaine de membres issus des laboratoires de 10 pays. Tapez "epigenetique" dans un catalogue de revues médicales, et vous obtiendrez pas moins de 45.000 références. Une revue entière, Epigenetics, lui est même consacrée. Du cancer au diabète en passant par l'asthme, les laboratoires du monde entier s'empressent de réexaminer toutes les pathologies possibles sous l'angle épigénétique. Même la dépendance à l'alcool ou à la cocaïne. Tandis que les chercheurs étudient l'autisme à l'université Johns-Hopkins (Baltimore), la schizophrénie à l'université de Californie et l'athérosclérose (rigidification et obstruction des artères) à l'université de Virginie, ceux de l'institut Karolinska, en Suède, s'intéressent au diabète de type 2. Ils ont découvert que chez les personnes malades, le gène PGC-1a qui régule le métabolisme du glucose serait affublé d'un groupe méthyle. Une inactivation qui empêche les cellules de bien utiliser le glucose. À l'institut Garvan de Sydney, en Australie, c'est le cancer du sein que l'on étudie. Dans les cellules cancéreuses, le gène suppresseur de tumeur P16 serait lui aussi doté d'une molécule de méthyle et donc réduit au silence. En surveillant cette modification aux différents stades de la maladie, les scientifiques espèrent avoir trouvé là un outil de diagnostic précoce. La présence du groupe méthyle serait pour les médecins une sorte de marqueur pour déterminer si une femme est sur le point de développer un cancer.
Pour tirer parti de toutes ces observations, le NIH a engagé, en octobre 2009, 190 millions de dollars pour dresser "l'épigénome" : une carte complète de l'ADN indiquant, pour chaque cellule saine ou malade, les zones du gène où se fixent les molécules de méthyle. Le Pr Joseph Ecker, du laboratoire d'analysegénomique du Salk Institute, en Californie, vient d'annoncer qu'il avait achevé la description de l'épigénome d'une cellule souche et d'une cellule issue du poumon (fibroblaste). "Dresser la carte épigénétique d'une cellule saine fournit un profil de référence que nous pourrons comparer à celui des cellules malades, explique  Joseph Ecker. C'est la promesse de pouvoir comprendre les mécanismes en jeu dans les maladies comme le diabète, Alzheimer, le cancer, les maladies cardio-vasculaires..." Un enthousiasme que tous les chercheurs ne partagent pas : "Nous sommes en train de recycler l'idée du décryptage du génome humain qui a pourtant déjà montré ses limites, prévient Andras Paldi. Au lieu de se focaliser sur la description et le recensement de mécanismes biochimiques à petite échelle, nous aurions besoin de prendre du recul pour comprendre la totalité du phénomène."
Joseph Ecker. C'est la promesse de pouvoir comprendre les mécanismes en jeu dans les maladies comme le diabète, Alzheimer, le cancer, les maladies cardio-vasculaires..." Un enthousiasme que tous les chercheurs ne partagent pas : "Nous sommes en train de recycler l'idée du décryptage du génome humain qui a pourtant déjà montré ses limites, prévient Andras Paldi. Au lieu de se focaliser sur la description et le recensement de mécanismes biochimiques à petite échelle, nous aurions besoin de prendre du recul pour comprendre la totalité du phénomène."
Contrairement aux apparences, ces deux souris ont bien le même génome. Celle de droite a suivi un régime riche en méthyle, qui a modifié l'activité d'un gène lié notamment à la couleur du pelage et à l'obésité.
LA RECHERCHE SUR LES ÉPIMÉDICAMENTS S'ATTACHERA À LA LUTTE CONTRE LE CANCER
Mais la machine s'est emballée. Les chercheurs rêvent déjà de "thérapie épigénétique". La thérapie génique projetait de remplacer un gène défectueux par un gène sain. La thérapie épigénétique, elle, cible l'activité des enzymes. En théorie, la manouvre est plus aisée car les modifications qu'elles apportent n'ont rien d'immuable : "Contrairement aux mutations des gènes, les altérations épigénétiques sont réversibles, explique Joseph Ecker. Il suffit de bloquer les enzymes responsables. C'est là une opportunité unique d'inventer des médicaments qui inverseraient le processus de la maladie." Malgré l'enthousiasme qu'elle suscite, la recherche sur ces épimédicaments est pour l'instant embryonnaire. Si elle se développe, ce sera sans doute dans la lutte contre le cancer. "Dans notre corps, il existe plusieurs systèmes pour empêcher la croissance anarchique des cellules", explique Hinrich Gronemeyer qui dirige le projet européen Epitron à l'Institut de génétique et de biologie moléculaire et cellulaire de Strasbourg. "Citons les gènes "suppresseurs de tumeurs" ou ceux qui conduisent les cellules à se différencier au lieu de se multiplier. Dans une cellule cancéreuse, ces gènes sont éteints." Rallumer ces gènes bloquerait la progression du cancer.
Chez l'homme, le Vorinostat, un médicament, est déjà utilisé aux États-unis pour lutter contre certains lymphomes. S'il n'est pour l'instant autorisé en France que sous certaines conditions, il est censé empêcher les enzymes HDAC de bloquer l'accès aux gènes. En France, pour lutter contre les syndromes myélodysplasiques (anémies réfractaires), on utilise déjà des molécules (azacytidine) qui évitent l'interruptionde la lecture de l'ADN par des enzymes DNMT. Et d'autres applications devraient suivre. "Comment être sûr qu'avec ces molécules on agit uniquement sur le gène voulu et pas sur la totalité du génome ? remarque  Andras Paldi. Nous ne savons pas vraiment quel est le mode d'action dans l'organisme, c'est un peu comme taper sur la télé quand elle déraille : parfois ça marche, parfois non, mais on ne sait pas pourquoi." Dans la notice de l'azacytidine, le chapitre sur les mécanismes d'action est en effet rédigé au conditionnel.
Andras Paldi. Nous ne savons pas vraiment quel est le mode d'action dans l'organisme, c'est un peu comme taper sur la télé quand elle déraille : parfois ça marche, parfois non, mais on ne sait pas pourquoi." Dans la notice de l'azacytidine, le chapitre sur les mécanismes d'action est en effet rédigé au conditionnel.
AUTRE VOIE DE RECHERCHE : LES microARN
Cet été, l'équipe de Joshua Mendell, de l'université Johns-Hopkins de Baltimore, a montré que les cellules d'un foie cancéreux comportent beaucoup moins de microARN 26a que celles d'un foie sain. Habituellement, ce microARN bloque la fabrication de cycline, une protéine qui intervient dans la multiplication cellulaire. Sans lui, les cellules prolifèrent. En injectant le microARN manquant, les chercheurs ont obtenu une régression très nette de la tumeur au bout de trois semaines dans 8 cas sur 10. Mais ces résultats n'ont été obtenus que chez la souris. "La thérapie génique a déçu, car les espoirs entrevus étaient surdimensionnés, rappelle Andras Paldi. J'espère qu'on ne fera pas la même erreur avec la thérapie épigénétique."
Dans le labo strasbourgeois, c'est l'effervescence. L'équipe d'Hinrich Gronemeyer vient de mettre au point une molécule baptisée "Uvi 5008". Dérivée de la psammapline, substance extraite de l'éponge, elle agirait sur 3 fronts à la fois : bloquer les HDAC comme le Vorinostat, les DNMT comme l'azacytidine, mais aussi réactiver les gènes suppresseurs de tumeur et provoquer la mort des cellules malades grâce à une autre classe d'enzymes, les sirtuines. Une combinaison inédite : "Nous avons démontré sur la souris que cette triple action rend notre molécule plus efficace que le Vorinostat", s'enthousiasme Hinrich Gronemeyer. Les essais sont en phase préclinique. Le brevet est déposé, l'affaire à suivre. L'épigénétique n'a pas fini de faire parler d'elle.
MANGER POUR LA SANTÉ DE SES GÈNES ?
Pourrait-on "commander" l'activité de nos gènes en choisissant notre alimentation ? C'est la question que pose la nutrigénomique. Première option : jouer sur la quantité de méthyle dans le corps, cette molécule dont la présence ou l'absence sur l'ADN suffit à inhiber ou activer un gène. On la trouve dans les épinards, l'ail, les haricots secs, le tofu, le poulet, le poisson, les oufs, la laitue ou les arachides. Par ailleurs, l'acide folique des haricots, légumes à feuilles, pois, graines de tournesol ou foie est aussi métabolisé en méthyle. Deuxième option : jouer sur le degré de compactage de l'ADN qui permet ou pas aux gènes de s'exprimer. Les chercheurs de l'université de l'Oregon (États-Unis) ont montré qu'en bloquant l'enzyme responsable de ce compactage, le sulforaphane présent dans le brocoli réactivait les gènes suppresseurs de tumeur. Il ne s'agit pour l'instant que d'études ponctuelles. Des années de recherche seront nécessaires avant d'aboutir à des recommandations diététiques.
A.C. - Illustration D.B. - ÇA M'INTÉRESSE > Janvier > 2010 |