Maladie du Sommeil |
 La trypanosomiase africaine, couramment appelée maladie du sommeil, est une forme de trypanosomiase, une maladie parasitaire provoquée par un trypanosome (protozoaire flagellé), qui est transmis par la piqûre de la mouche tsé-tsé ou glossine et qui affecte les humains et les animaux. Trypanosoma brucei dans le sang d'un patient atteint de trypanosomiase africaine, couramment appelée maladie du sommeil. (->)
La trypanosomiase africaine, couramment appelée maladie du sommeil, est une forme de trypanosomiase, une maladie parasitaire provoquée par un trypanosome (protozoaire flagellé), qui est transmis par la piqûre de la mouche tsé-tsé ou glossine et qui affecte les humains et les animaux. Trypanosoma brucei dans le sang d'un patient atteint de trypanosomiase africaine, couramment appelée maladie du sommeil. (->)
Les Protozoaires, étant unicellulaires, sont de petits organismes de moins d'un millimètre, pouvant s'associer en colonies. Ils vivent exclusivement dans l'eau ou dans de la terre humide. Ils sont connus pour être responsable de nombreuses maladies telles que la malaria et certaines dysenteries telle que l'amibiase.
Deux sous-espèces d'un trypanosome (Trypanosoma brucei) génèrent chez l'humain des pathologies différentes :
- Trypanosoma brucei ssp.gambiense (Afrique de l'Ouest)
- Trypanosome brucei ssp. rhodensiense (Afrique de l'Est)
La maladie est endémique dans certaines régions de l'Afrique sub-saharienne, couvrant environ 36 pays et menaçant potentiellement 60 millions de personnes. On estime que 50.000 à 70.000 personnes sont actuellement infectées par an, le nombre ayant diminué légèrement ces dernières années.
Trois épidémies majeures se sont produites ces cent dernières années, une en 1896-1906 et les deux autres en 1920 et 1970. La trypanosomiase du bétail est appelée Nagana ("être déprimé" en Zoulou).
Caractéristiques cliniques
Les symptômes commencent par de la fièvre, des maux de tête, et des douleurs articulaires. Comme les parasites pénètrent dans l'organisme à la fois par le sang et par le système lymphatique, les ganglions lymphatiques gonflent souvent et atteignent des tailles énormes. Le signe de Winterbottom, adénopathies cervicales postérieures (ganglions derrière le cou) peut apparaître. En l'absence de traitement, la maladie déborde progressivement les défenses de la personne infectée, et de nouveaux symptômes apparaissent, notamment l'anémie, les troubles endocriniens, cardiaques, et rénaux. La maladie entre alors dans sa phase de troubles neurologiques quand le parasite traverse la barrière hématoencéphalique. Les symptômes de cette deuxième phase donnent son nom à la maladie ; en plus de la confusion mentale et des troubles de la coordination, le cycle du sommeil est perturbé, ce qui entraîne des accès de fatigue alternant avec des périodes d'agitation maniaque apparaissant le jour avec un assoupissement et la nuit avec l'insomnie. Sans traitement, la maladie est mortelle, avec une détérioration mentale progressive aboutissant au coma et à la mort. Les dommages causés dans la phase neurologique peuvent être irréversibles.
En plus de la piqûre par la mouche tsé-tsé, la maladie peut se contracter de la manière suivante :
- De la mère à l'enfant : le trypanosome peut traverser la barrière placentaire et infecter le fotus, avec un risque de mort périnatale.
- En laboratoire : infections accidentelles, par exemple, au cours de la manipulation du sang d'une personne infectée ou par une transplantation d'organe, bien que ce soit rare.
- Sexuellement : avoir des rapports non protégés avec une personne atteinte pourrait la transmettre mais les cas avérés sont anecdotiques.
Distribution géographique et épidémiologique
La maladie se rencontre sous deux formes, selon le parasite en cause, Trypanosoma brucei gambiense ou Trypanosoma brucei rhodesiense. T.B.gambiense se trouve en Afrique centrale et occidentale ; il provoque une atteinte chronique qui peut se prolonger sous une forme passive pendant des mois ou des années avant que les symptômes apparaissent. Le T.B. rhodesiense, est à l'origine d'une forme aiguë de la maladie mais il entraîne des effets beaucoup plus limités. On le trouve en Afrique méridionale et orientale ; l'infection débute en quelques semaines, est plus virulente et se développe plus rapidement. Selon des estimations récentes, la maladie du sommeil est responsable d'une perte d'espérance de vie (de 9 à 10 ans) pour 2 millions de personnes. Les évaluations récentes indiquent que plus de 60 millions de personnes réparties dans 250 foyers environ sont en danger de contracter la maladie, et il y a environ 300.000 nouveaux cas tous les ans.
La maladie a été constatée dans 36 pays, tous en Afrique sub-saharienne. Les humains sont le réservoir principal pour Trypanosoma brucei gambiense, mais d'autres espèces peuvent également être retrouvées chez les porcs et d'autres animaux. Les animaux sauvages et le bétail sont le réservoir principal de T.B. rhodesiense.
Les Taons (Tabanidae) et Stomoxydinae peuvent probablement jouer un rôle dans la transmission passive (dans des situations spéciales) non seulement pour le Nagana (la forme animale de la maladie du sommeil) mais également de la forme humaine de la maladie.
 Cycle parasitaire
Cycle parasitaire
La mouche tsé-tsé est grande, brune et furtive. La piqûre est ressentie comme une aiguille chaude enfoncée dans la chair.
Pendant un repas de sang sur le mammifère hôte, une mouche tsé-tsé infectée du (genre Glossina) injecte les trypomastigotes métacycliques dans le tissu cutané. Les parasites entrent dans le système lymphatique et passent dans la circulation sanguine (1). À l'intérieur de l'hôte, ils se transforment en trypomastigotes circulants dans le sang (2) et sont transportés à d'autres emplacements dans tout le corps, atteignent d'autres fluides biologiques (par exemple, lymphe, liquide céphalo-rachidien), et continuent de se répliquer par scissiparité (3). Le cycle parasitaire du Trypanosome africain est représenté par des étapes extracellulaires. Une mouche tsé-tsé s'infecte par des trypomastigotes circulants en prenant un repas de sang sur un mammifère infecté hôte (4)(5). (Dans l'intestin de la mouche, les parasites se transforment en trypomastigotes procycliques, se multiplient par scissiparité (6), quittent l'intestin, et se transforment en épimastigotes (7). Les épimastigotes atteignent les glandes salivaires de la mouche et continuent leur multiplication par scissiparité (8). Le cycle dans la mouche dure approximativement 3 semaines.
WIKIPEDIA > Novembre > 2009 |
La Maladie du Sommeil Berne nos Globules Blancs |
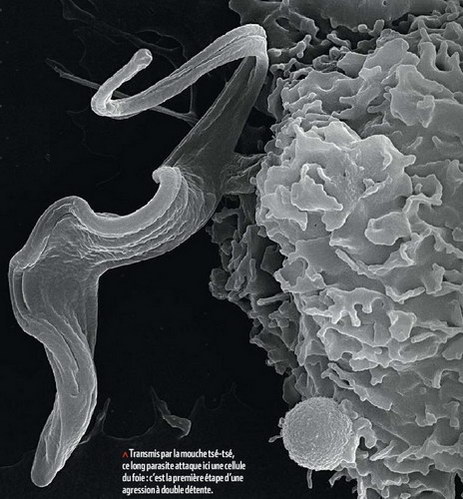 Sacrifier les premiers soldats sur les défenses ennemies pour permettre à la troupe de passer : telle est la stratégie du trypanosome.
Sacrifier les premiers soldats sur les défenses ennemies pour permettre à la troupe de passer : telle est la stratégie du trypanosome.
Répandu en Afrique centrale, ce parasite est responsable de la terrible maladie du sommeil. Il pénètre dans le sang grâce à la piqûre de la mouche tsé-tsé qui lui sert de vecteur. "L'arrivée des premiers trypanosomes dans le foie et la rate provoque un afflux massif de globules blancs", explique Etienne Pays, de l'université libre de Bruxelles, dont l'équipe vient d'élucider les phases précoces de la pénétration du parasite. Cette première ligne de défense est efficace : les globules blancs avalent et digèrent les premiers envahisseurs. Mais ces éclaireurs ne meurent pas en vain... Au moment de leur destruction, ils se mettent à produire intensivement une petite molécule, l'AMP cyclique, qui, à son tour, empêche les globules blancs de synthétiser le TNF-∞. Or, en l'absence de ce signal chimique, la riposte secondaire des défenses immunitaires est affaiblie. Une véritable stratégie à double détente donc... "Nous savions déjà que le tzypanosome était capable d'une grande variabilité de ses antigènes, ce qui rend la mise au point d'un vaccin difficile, reprend Etienne Pays. Or, nos travaux révèlent qu'il possède aussi un mécanisme qui lui permet d'échapper au système immunitaire de l'hôte".
O.C. - SCIENCE & VIE > Août > 2012 |
Des Chercheurs auraient Démasqué le Trypanosome |
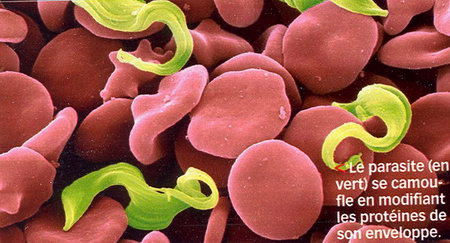 Le parasite responsable de la maladie du sommeil (Trypanosoma brucel) trafique son propre ADN pour mieux duper les défenses immunitaires de son hôte !
Le parasite responsable de la maladie du sommeil (Trypanosoma brucel) trafique son propre ADN pour mieux duper les défenses immunitaires de son hôte !
Il parvient ainsi à se travestir en changeant la nature des protéines tapissant son enveloppe, les VSG (Variant Surface Glycoproteins). Chaque trypanosome en possède plus de 1000 variantes, qui le rendent difficilement détectable par les cellules immunitaires. Catharine Boothroyd de l'université Rockefeller, aux États-Unis, et ses collègues ont compris le mécanisme de ce "déguisement" en identifiant, dans le génome du parasite, le site impliqué dans la variation des VSG. D'après les auteurs, ce mécanisme "d'auto-clivage" de l'ADN pourrait s'étendre à d'autres micro-organismes pathogènes résistants au système immunitaire.
D.O. - SCIENCE & VIE > Juin > 2009 |
